ELEMENTOS CONSTITUINTES DA MATÉRIA
Podemos definir matéria como sendo tudo aquilo que tem massa e ocupa lugar no espaço. Toda matéria é formada por pequenas partículas, designadas átomos.
Em 1808, se baseando em fatores experimentais, o cientista britânico John Dalton (1766-1844), formulou uma teoria, a chamada teoria atômica de Dalton que define:
1- Pequenas partículas esféricas, maciças e indivisíveis, nomeadas átomos, constituem a matéria.
2- Elemento químico é composto de um conjunto de átomos com as mesmas massas e tamanhos.
3- Elementos químicos diferentes indicam átomos com massas, tamanhos e propriedades diferentes.
4- Substâncias diferentes são resultantes da combinação de átomos de elementos diversos.
5- A origem de novas substâncias está relacionada ao rearranjo dos átomos, uma vez que eles não são criados e nem destruídos.
2- Elemento químico é composto de um conjunto de átomos com as mesmas massas e tamanhos.
3- Elementos químicos diferentes indicam átomos com massas, tamanhos e propriedades diferentes.
4- Substâncias diferentes são resultantes da combinação de átomos de elementos diversos.
5- A origem de novas substâncias está relacionada ao rearranjo dos átomos, uma vez que eles não são criados e nem destruídos.

Modelo atômico de Dalton
São exemplos de matérias o ferro, a madeira, a água, e existem matérias que não podem ser vistas como é o caso do ar que respiramos.
Através da matéria podemos dar origem a materiais (objetos). Exemplificando seria assim: com um pedaço de madeira o carpinteiro faz um móvel, o ferro é usado para fabricar ferramentas.
Surge assim outra definição, a de corpo e objeto: Corpo é qualquer porção limitada de matéria e objeto, é aquilo que o corpo se transforma quando é trabalhado.
Mais exemplos: o escultor usa um pedaço de mármore (corpo) para fazer uma estátua (objeto). O ourives faz um anel (objeto), de uma barra de ouro (corpo).
Ao relacionarmos matéria com o exemplo, ficaria assim:
Através da matéria podemos dar origem a materiais (objetos). Exemplificando seria assim: com um pedaço de madeira o carpinteiro faz um móvel, o ferro é usado para fabricar ferramentas.
Surge assim outra definição, a de corpo e objeto: Corpo é qualquer porção limitada de matéria e objeto, é aquilo que o corpo se transforma quando é trabalhado.
Mais exemplos: o escultor usa um pedaço de mármore (corpo) para fazer uma estátua (objeto). O ourives faz um anel (objeto), de uma barra de ouro (corpo).
Ao relacionarmos matéria com o exemplo, ficaria assim:
Matéria- ouro
Corpo- barra de ouro
Objeto- anel
ESTADOS FÍSICOS DA MATÉRIA
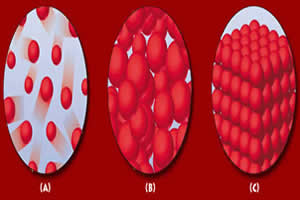
Moléculas no estado gasoso, líquido e sólido.
A matéria é composta por pequenas partículas e, de acordo com o maior ou menor grau de agregação entre elas, pode ser encontrada em três estados: sólido, líquido e gasoso.
O volume, a densidade e a forma de um composto podem variar com a temperatura, sendo assim, os compostos apresentam características de acordo com o estado físico em que se encontram, veja as características de cada um:
Estado Sólido: as moléculas da matéria se encontram muito próximas, sendo assim possuem forma fixa, volume fixo e não sofrem compressão. Por exemplo: em um cubo de gelo as moléculas estão muito próximas e não se deslocam.
Estado Líquido: as moléculas estão mais afastadas do que no estado sólido e os elementos que se encontram nesse estado possuem forma variada, mas volume constante. Além dessas características, possui facilidade de escoamento e adquirem a forma do recipiente que os contém.
Estado Gasoso: a movimentação das moléculas nesse estado é bem maior que no estado líquido ou sólido. Se variarmos a pressão exercida sobre um gás podemos aumentar ou diminuir o volume dele, sendo assim, pode-se dizer que sofre compressão e expansão facilmente. Os elementos gasosos tomam a forma do recipiente que os contém.
Essas características obedecem a fatores como a Força de Coesão (faz com que as moléculas se aproximem umas das outras) e a Força de Repulsão (as moléculas se afastem umas das outras). No estado gasoso a Força de Repulsão predomina, enquanto que no estado sólido é a Força de Coesão.
Assim, quando uma substância muda de estado físico sofre alterações nas suas características microscópicas (arranjo das partículas) e macroscópicas (volume, forma), sendo que a composição continua a mesma.
TRANSFORMAÇÕES DA MATÉRIA

Solidificação da água: fenômeno físico.
Toda e qualquer modificação que ocorre com a matéria pode ser considerada um fenômeno, e eles são classificados em fenômenos físicos e químicos.
Fenômenos Físicos: a substância pela qual a matéria é formada não passa por transformação alguma, ou seja, não passa por mudanças. Sendo assim, sua forma, seu tamanho, sua aparência, podem mudar, mas não sua composição.
Exemplo: Solidificação da água. A substância, no caso a água, estava no estado líquido e passou para o estado sólido, sua forma e tamanho mudaram, mas seus constituintes não.
Fenômenos Químicos: a composição da matéria passa por mudanças, ou seja, uma ou mais substâncias se alteram dando origem a compostos diferentes.
Mas como saber se uma determinada matéria passou por alguma transformação química. É fácil! A formação de uma nova substância pode ser identificada pelos seguintes fenômenos:
Alteração na cor. Exemplo: quando queimamos o papel ele passa de branco para preto, é uma transformação em seu estado químico.
Surgimento de chama ou luminosidade. Exemplo: queima do álcool.
Efervescência (liberação de um gás). Exemplo: quando dissolvemos um antiácido estomacal em água.
CLASSIFICAÇÃO DA MATÉRIA
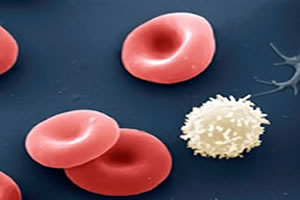
O sangue é uma mistura heterogênea.
A matéria pode ser definida como sendo tudo aquilo que tem massa e ocupa lugar no espaço, ela é formada por pequenas partículas, designadas átomos e esses podem se unir de várias maneiras, formando as moléculas. A matéria pode se agrupar através dos átomos e formar os mais variados produtos que se classificam em:
Substâncias e Misturas.
As substâncias se diferem em dois tipos, de acordo com suas composições:
Substâncias simples: essas apresentam apenas um elemento, ou seja, apenas um tipo de átomo que pode estar agrupado em moléculas ou isolado.
Exemplos: Hidrogênio (H2) e Hélio (He). Repare que o nome da substância simples pode ser o mesmo do elemento que a constitui ou pode ser diferente, como é o caso do Gás Ozônio (O3).
Substâncias compostas: também chamadas de compostos, essas substâncias são formadas por mais de um elemento químico.
Exemplos: Água (H20), Gás cianídrico (HCN), Gás carbônico (CO2), Amônia (NH3).
Observação importante: A substância pura é aquela que apresenta apenas um tipo de molécula, seja ela simples ou composta. Exemplificando ficaria assim:
Oxigênio (O2) - substância pura simples Metano (CH4) – substância pura composta
Misturas: quando a molécula apresenta mais de uma substância pura é chamada de mistura. A água oxigenada é um exemplo, pois ela contém água (H2O) e peróxido de hidrogênio (H2O2). As misturas podem se classificar emMisturas homogêneas ou heterogêneas.
Antes de prosseguir é preciso saber: o que é fase? É quando observamos uma determinada mistura a olho nu e vemos apenas um aspecto uniforme de cada fração.
Se, por exemplo, forem colocados em um recipiente areia, água e óleo, veremos que a mistura possui três fases.
Misturas homogêneas: essas misturas apresentam uma única fase. Quando misturamos água e álcool, nem com o auxílio de um microscópico poderíamos ver a separação dos dois líquidos, dizemos então que a mistura possui uma só fase, ou seja, é uma mistura homogênea.
Misturas heterogêneas: são misturas que apresentam mais de uma fase, temos o exemplo da água e do óleo quando se misturam. Seria fácil perceber nesse caso, o aspecto visual heterogêneo - a água se separa completamente do óleo - sendo assim, a mistura se torna heterogênea porque vemos nela duas fases.
Vejamos os exemplos:
1. O leite é uma mistura homogênea quando observamos a olho nu, mas com o auxílio de um microscópico é possível perceber gotículas de gordura em suspensão, e quando aquecemos o leite elas se unem formando a nata.
2. A fumaça que polui o meio ambiente, quando observada ao microscópico mostra minúsculas partículas de carvão suspensas.
3. O granito é formado por quartzo, feldspato e mica, possui três fases, é, portanto, uma mistura heterogênea.





